心理所研究发现刻画个体疼痛敏感性的神经指标
疼痛,是一件自然演化赠予人们的最宝贵却无人想要的礼物。没有它,人们就失去了最重要的防身利器,极可能在童年就不幸夭折[1];有了它,人们就面临着潜在的无尽痛楚,甚至有三分之一左右的可能性被慢性疼痛长期折磨[2]。
虽然大多数人都能感受到疼痛,但有些人似乎完全不怕疼,“刮骨疗毒”也纹丝不动,而有些人则对疼痛极度敏感,针刚碰到皮肤就痛得直跳。除了日常观察以外,众多科学研究也证实了这一点:不同个体对疼痛的敏感性有着极大的差异[3-5]。值得注意的是,怕不怕疼并非是件小事,而是一件具有重大临床意义的大事。疼痛敏感性个体差异的有效评估对个体止痛药(如在北美掀起狂风骤雨的阿片类药物滥用危机)的用量和疗效评价等都有着重要的指导意义。
正因如此,疼痛领域多年来一直致力于研究能够刻画个体疼痛敏感性差异的神经标记物。然而,以往的研究常常混淆同一个体对不同强度疼痛的感受差异(个体内差异)和不同个体对同一强度疼痛的感受差异(个体间差异),而且研究结果也存在诸多不一致之处。针对这些问题,中国科学院心理健康重点实验室胡理研究员与伦敦大学学院Giandomenico Iannetti教授合作,采用跨物种研究方法,结合心理物理学测量和电生理技术,发现了高频γ振荡信号能可靠且特异地预测个体疼痛敏感性。研究成果已于1月14日在线发表于国际知名期刊美国科学院院刊PNAS[6]。
整个研究由3个不同的实验组成。实验1首先招募了96名志愿者(51名女性,年龄21.6 ± 1.7岁),记录他们在接受不同强度激光热痛刺激时的疼痛评分及脑电(EEG)数据。为分离疼痛敏感性的个体内差异和个体间差异,研究者将数据分成两个不同的层次,一是由单个个体对不同疼痛刺激的所有行为评分和脑电响应组成的个体内数据,二是将个体对不同疼痛刺激的行为评分和脑电响应平均后得到的个体间数据。这两个层次分别对应了个体内差异和个体间差异。
结果显示,所有由短时激光刺激诱发的EEG响应特征均能较好地反映个体内的疼痛敏感性,包括时域内刺激呈现后120~200 ms内的N1成分、180~300 ms内的N2成分和250~500 ms内的P2成分,以及时频域内的激光诱发电位(LEP)、低频α事件相关去同步化(α-ERD)和高频γ事件相关同步化(γ-ERS),但仅有γ-ERS能刻画个体间的疼痛敏感性(图1),且这一结果无法由不同EEG指标的灵敏度差异解释。进一步的数据分析显示,高频γ事件相关同步化能准确预测个体的疼痛敏感性,预测的疼痛评分与真实疼痛评分相关高达0.931(图2)。
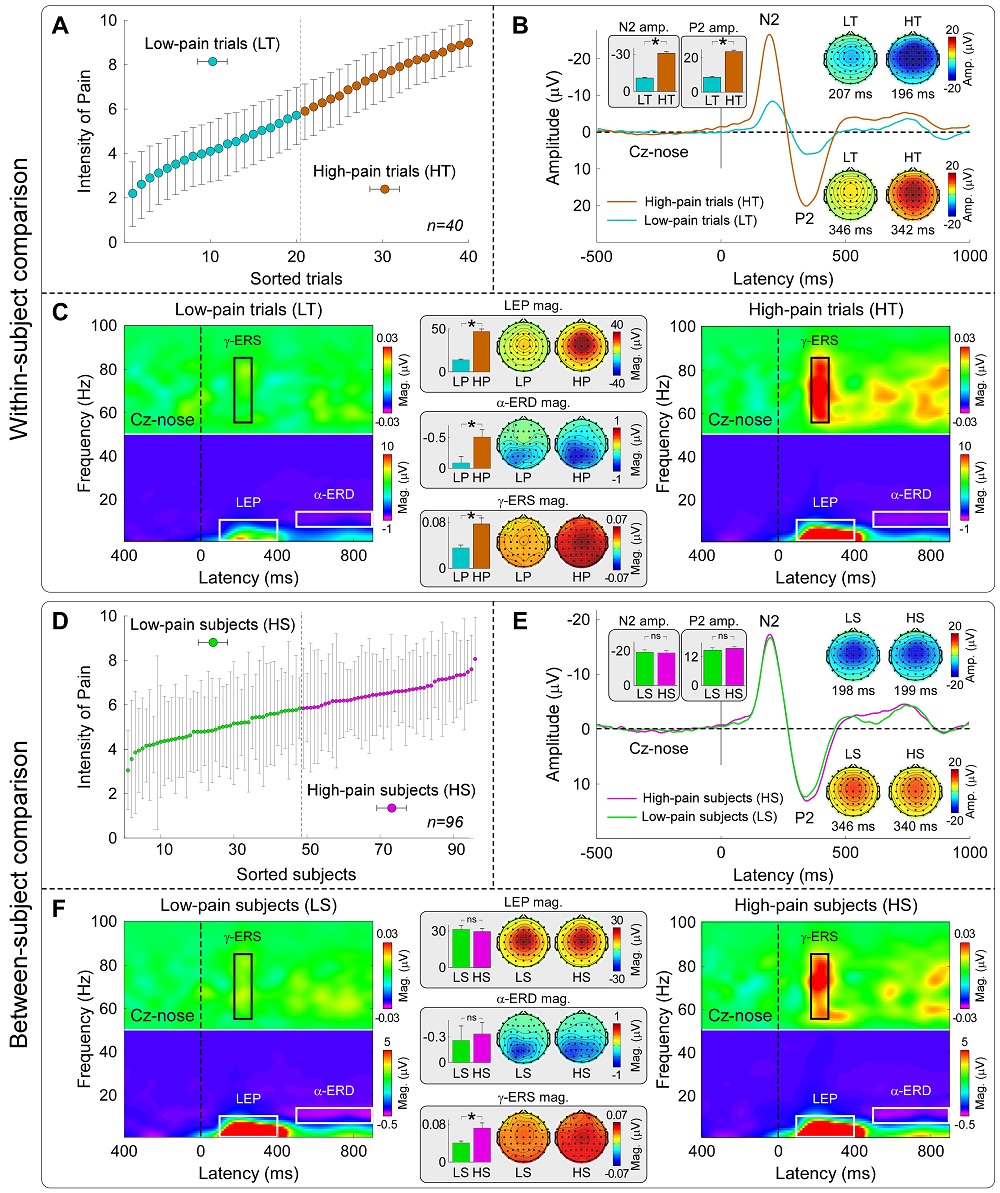
图 1 个体内和个体间疼痛敏感性预测指标的比较
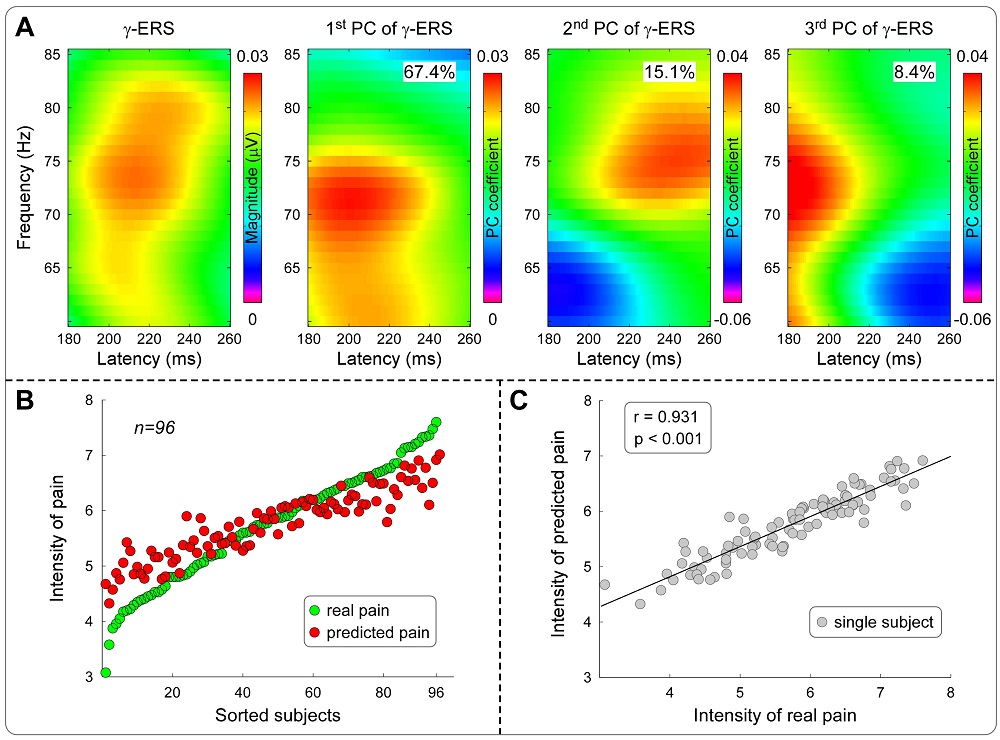
图 2 γ-ERS准确预测疼痛敏感性的个体差异
由于疼痛刺激具有高凸显性(saliency),为排除其干扰,实验2招募了107名志愿者(67名女性,年龄21.6±1.8岁),采集了包含不同强度的视觉、听觉、触觉等其它模态短时刺激诱发的EEG信号和相关的心理物理测量数据。结果显示,γ-ERS无法预测由视觉、听觉和触觉刺激引起的个体间感觉强度评分(图3)。这意味着,刺激凸显性无法解释实验1的研究结果,γ-ERS对感觉敏感性的预测具有疼痛特异性。
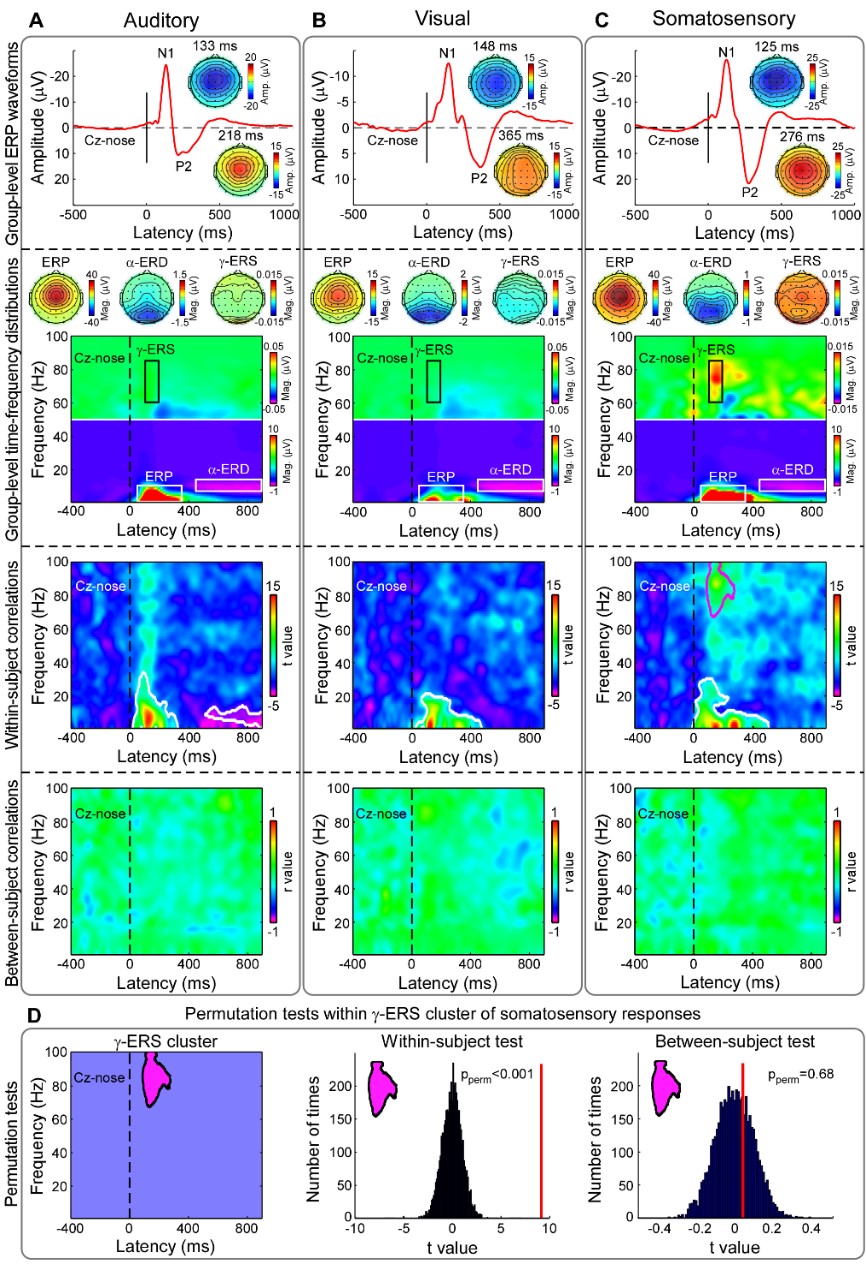
图 3 多模态感觉刺激诱发EEG脑响应在个体内与个体间差异的比较
实验1和实验2均以人类被试为研究对象探究疼痛敏感性个体差异的预测指标。为检验γ-ERS预测个体内和个体间疼痛敏感性的特性是否具有跨物种一致性,实验3进一步采集了来自12只成年雄性Sprague Dawley大鼠的听觉刺激诱发的颅内脑电响应(ECoG),并将其与胡理研究组之前发表的关于激光诱发γ-ERS与大鼠疼痛行为的研究数据[7]进行了汇总分析。结果与前两个实验的结果类似:由激光诱发的大鼠LEP和γ-ERS在个体内水平均与大鼠疼痛行为相关,但仅有γ-ERS在个体间水平与大鼠疼痛行为存在显著相关(图4),并且伤害性刺激诱发的γ-ERS的空间地形图分布与听觉刺激诱发的γ-ERS存在明显差异(图5)。可见,无论在人类还是大鼠身上,γ-ERS均能有效刻画个体间疼痛敏感性的差异,即具有跨物种的一致性。
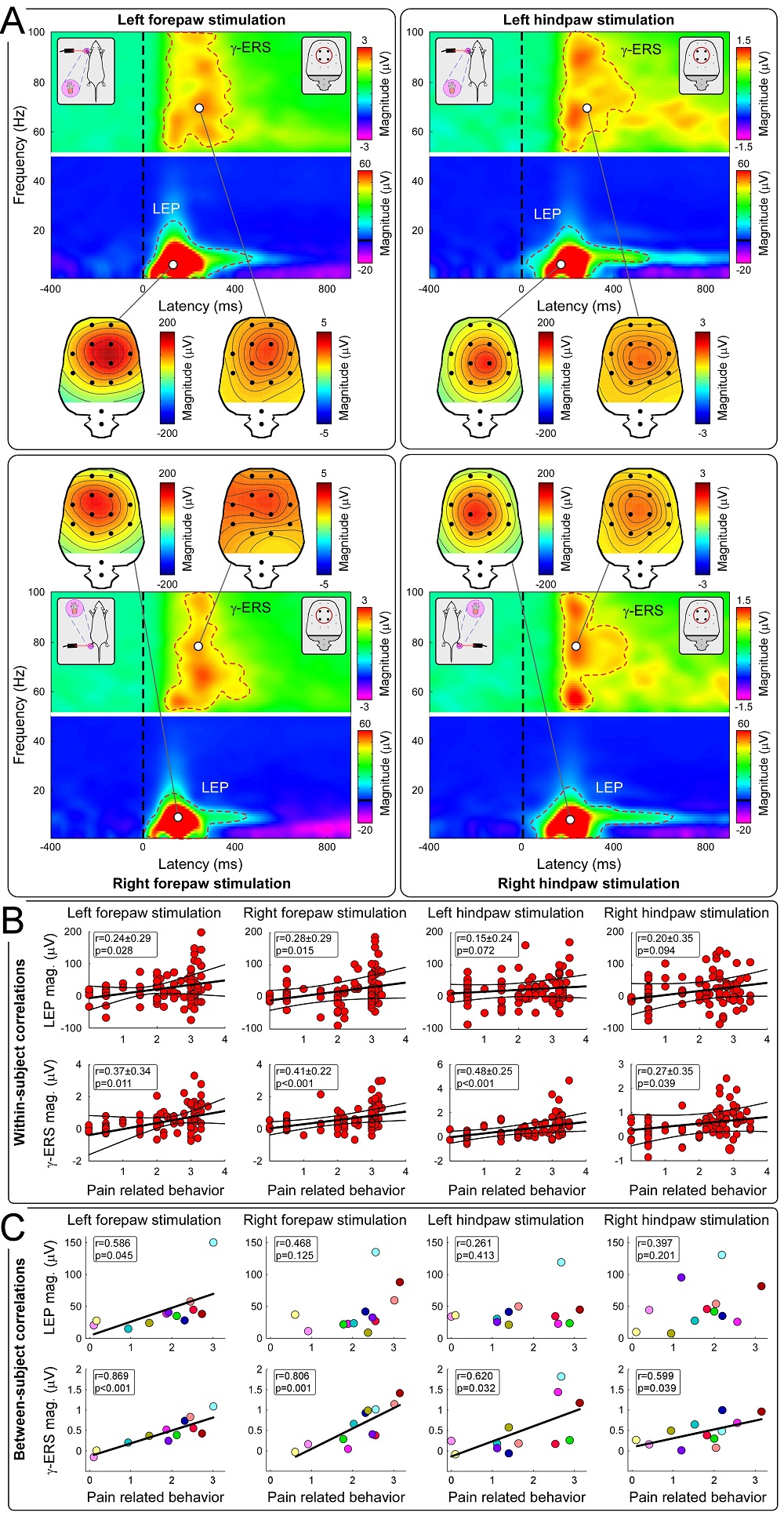
图 4 ECoG指标反映大鼠疼痛行为的个体内和个体间差异
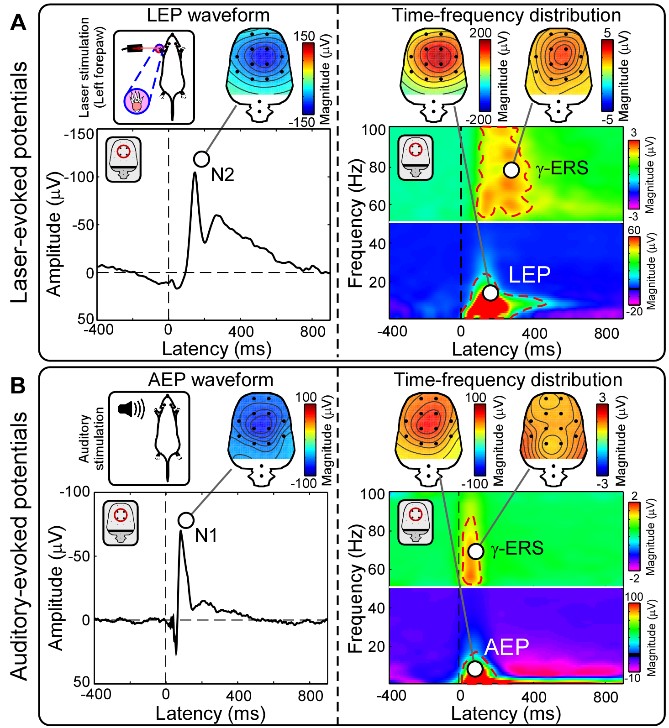
图 5 痛觉和听觉刺激诱发大鼠脑响应的差异比较
这些研究结果表明,γ-ERS能特异性地表征个体间疼痛敏感性,不编码具有同等凸显性水平的听觉、视觉和触觉刺激感觉强度的个体差异,并且该特性在人类和大鼠中具有跨物种一致性。总之,该研究发现了γ-ERS这一编码个体间疼痛敏感性的神经指标,也加深了人们对疼痛感知觉及其内在机制的理解,并对临床实践中如何实现个体化疼痛评估和管理提供了启示。
该研究受国家自然科学基金委项目(31671141 和 31822025)、中国科学院信息化专项(XXH13506-306)等资助。
论文信息:
Hu*, L., & Iannetti, G. D. (2019). Neural indicators of perceptual variability of pain across species. Proceedings of the National Academy of Sciences, 201812499. https://doi.org/10.1073/pnas.1812499116
论文链接:
https://www.pnas.org/content/early/2019/01/08/1812499116
参考文献:
[1] Nagasako, E. M., Oaklander, A. L., & Dworkin, R. H. (2003). Congenital insensitivity to pain: an update. Pain, 101(3), 213–219. https://doi.org/10.1016/S0304-3959(02)00482-7
[2] Chen, B., Li, L., Donovan, C., Gao, Y., Ali, G., Jiang, Y., … Sun, W. (2016). Prevalence and characteristics of chronic body pain in China: a national study. SpringerPlus, 5, 938. https://doi.org/10.1186/s40064-016-2581-y
[3] Clark, J. W., & Bindra, D. (1956). Individual differences in pain thresholds. Canadian Journal of Psychology/Revue Canadienne de Psychologie, 10(2), 69.
[4] Coghill, R. C., McHaffie, J. G., & Yen, Y.-F. (2003). Neural correlates of interindividual differences in the subjective experience of pain. Proceedings of the National Academy of Sciences, 100(14), 8538–8542.
[5] Nielsen, C. S., Price, D. D., Vassend, O., Stubhaug, A., & Harris, J. R. (2005). Characterizing individual differences in heat-pain sensitivity. Pain, 119(1–3), 65–74.
[6] Hu, L., & Iannetti, G. D. (2019). Neural indicators of perceptual variability of pain across species. Proceedings of the National Academy of Sciences, 201812499. https://doi.org/10.1073/pnas.1812499116
[7] Peng, W., Xia, X., Yi, M., Huang, G., Zhang, Z., Iannetti, G., & Hu, L. (2018). Brain oscillations reflecting pain-related behavior in freely moving rats: Pain, 159(1), 106–118. https://doi.org/10.1097/j.pain.0000000000001069
附件下载:

