心理所研究揭示慢波睡眠期间记忆重激活的“回声”效应
记忆在大脑中的存储与演化是一个复杂且动态的过程,其中一些记忆能够随着时间的推移而愈发清晰,而另一些则逐渐模糊甚至消失。这一现象长期以来吸引了科学界的广泛关注,研究者们致力于揭示其背后的神经机制。目前,科学界普遍认为,慢波睡眠在记忆的巩固和演化过程中扮演着关键角色。具体而言,新形成的记忆最初存储在海马体中,随后在睡眠期间通过记忆重激活的方式逐渐转移到新皮层,从而形成更为稳定的长期记忆。这一转移过程被认为是记忆巩固的核心机制之一。
尽管已有研究表明,睡眠期间的记忆重激活是记忆巩固的重要环节,但海马体与新皮层在这一过程中的动态交互机制仍不明确。理解这两者之间的相互作用对于全面揭示记忆巩固的神经机制至关重要。然而,迄今为止,尚未有研究对这一关键问题展开深入探讨。
为探究这一问题,中国科学院心理研究所王亮研究组开展了一项研究,探索海马体与新皮层在记忆重激活中的协同作用,以及这一过程如何受到睡眠阶段、神经振荡等因素的调控。该研究不仅有助于深化对记忆巩固机制的理解,还可能为记忆相关疾病的治疗提供新的思路。

该研究结合人类颅内脑电技术(intracranial EEG)与目标记忆重激活范式(Targeted Memory Reactivation, TMR),探讨了记忆重激活期间海马体与皮层的神经活动特征与信息交互模式。研究揭示了慢波睡眠期间目标记忆通过多次重激活机制增强记忆巩固的神经机制,并阐明了记忆再激活过程中海马尖波涟漪、皮层纺锤波以及海马-皮层神经交互作用的动态时空特征。
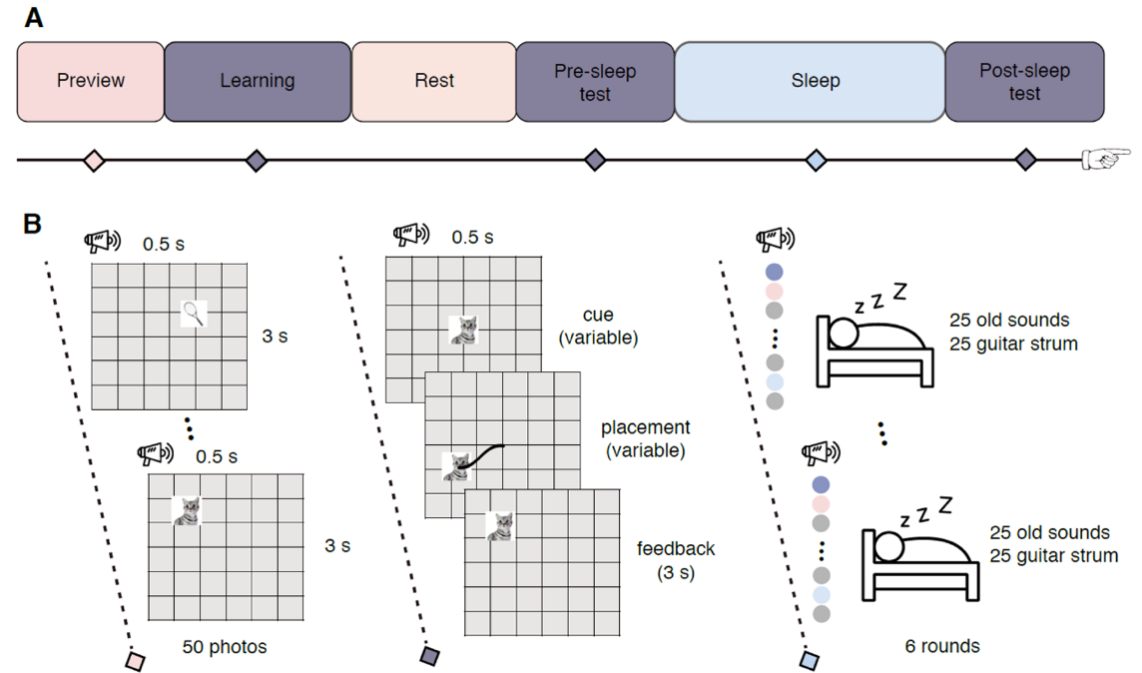
图1. 实验流程图
研究团队采用TMR实验范式,在学习物体-位置关联任务后的慢波睡眠阶段,通过播放特定声音线索重新激活记忆内容(图1)。同时,研究人员通过记录药物难治性癫痫患者的颅内脑电信号,同时监测海马和皮层的电生理活动,通过分析学习-睡眠之间脑活动模式的相似性衡量记忆的重激活强度(图2)。
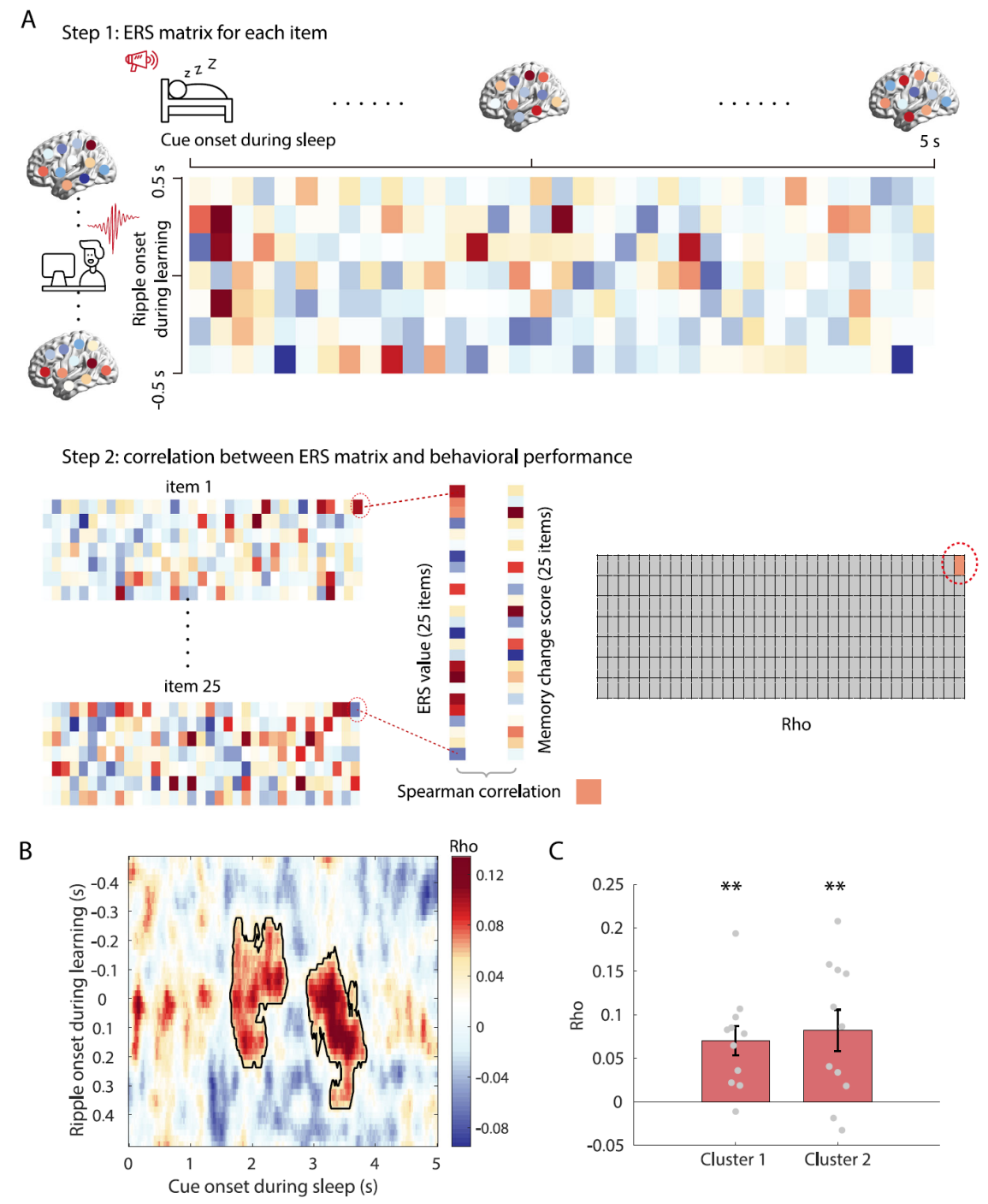
图2. 睡眠中的多次记忆重激活
研究者发现,在慢波睡眠期间播放声音刺激之后,记忆信息会出现两次分离的重激活现象(图2),第一次发生在声音播放之后的1.6到2.6秒,第二次发生在2.8到3.8秒。这一结果表明,深度睡眠期间的记忆巩固可能需要多次重激活。这种现象好比记忆信息在大脑中以慢波振荡的节奏产生的“回声”,其原因可能是因为皮层和海马之间需要通过多次的信息处理来实现记忆的巩固。那么,海马和新皮层的活动是否在第一次重激活和第二次的“回声”之间有区别呢?
海马尖波涟漪活动(ripple)和皮层纺锤波活动(spindle)在记忆固中非常重要,这两种特征波形的产生往往代表着记忆信息的整合加工。因此,研究者接下来分析了两次重激活之间,海马尖波涟漪和皮层纺锤波活动的具体情况(图3)。结果发现,第一次重激活期间,记忆增强组的海马尖波涟漪活动显著增强,而在第二次重激活期间确没有此现象。与此相反,记忆增强组的皮层纺锤波活动在第一次重激活期间并没有变化,而是在第二次重激活期间显著增强。
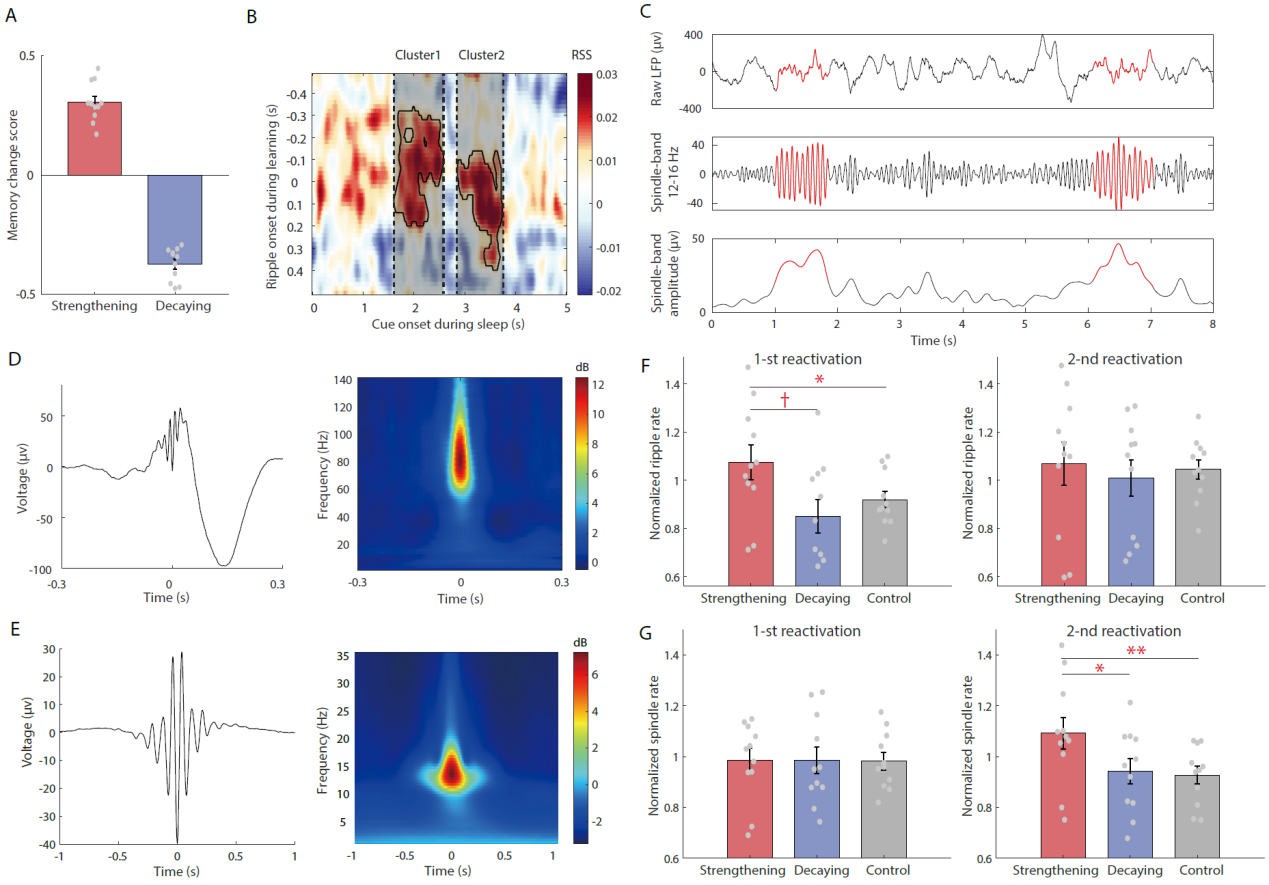
图3. 慢波睡眠期间海马尖波涟漪和皮层纺锤波
研究者进一步探究了海马-皮层同步性在两次再激活过程中的动态信息交互(图4)。结果表明,在第一次重激活过程中,记忆增强组海马-皮层的连通性显著增强,而在第二次重激活时连通性下降。这种海马-皮层连通性的反转效应可能反映了海马与皮层在记忆重激活早期的耦合和随后的解耦合对记忆巩固的促进作用。
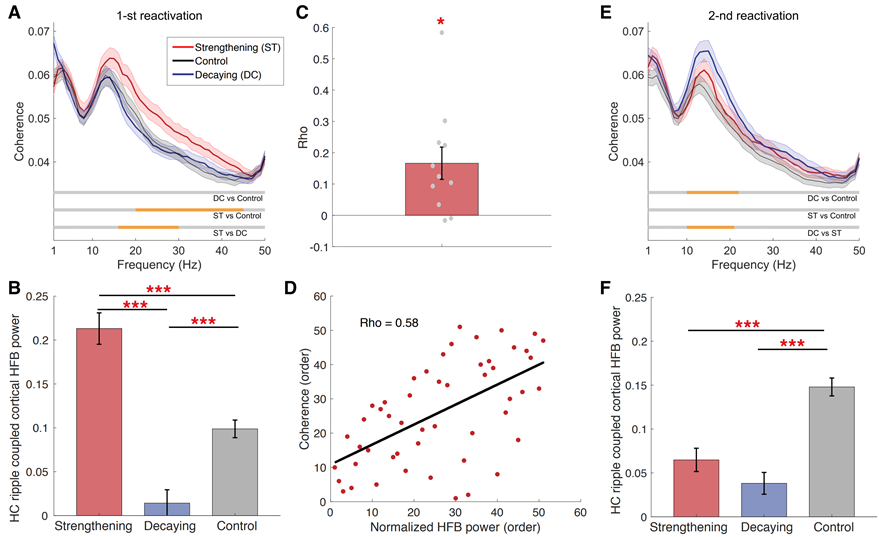
图4. 慢波睡眠期间海马-皮层的动态信息交互
基于上述结果,研究团队提出了一种动态模型来描述慢波睡眠期间记忆巩固的过程(图5)。慢波睡眠期间播放的声音线索会诱发多次的皮层重激活,而且在重激活发生期间通过皮层和海马之间交替的耦合与去耦合选择性促进记忆巩固。具体表现为,第一次重激活期间,海马通过功能连接和跨脑区耦合的高频神经振荡与皮层进行交互,在第二次重激活期间,皮层和海马发生去耦合,此时皮层独立处理记忆信息,表现为皮层纺锤波活动的增强。
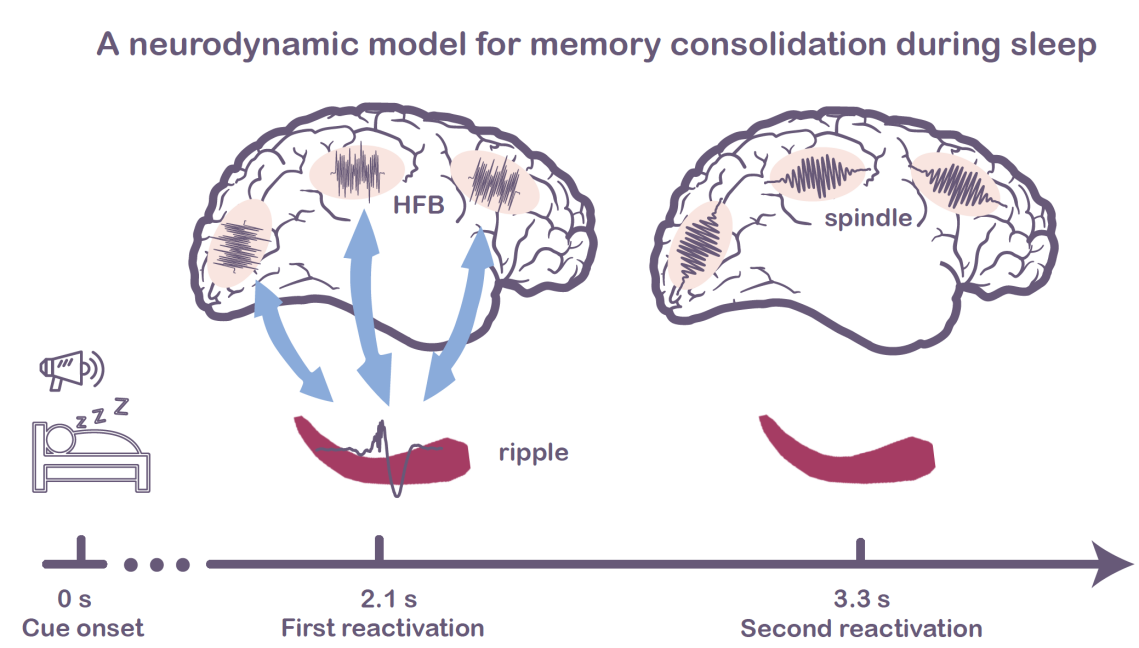
图5. 睡眠中选择性记忆巩固的神经动力学模型
该研究获得基金委重点国际合作项目(32020103009)和科技创新2030重大项目(2022ZD0205000)的资助。
相关成果已在线发表于Nature Communications。心理所博士研究生段威和天津师范大学心理学院徐战胜博士为论文共同第一作者,心理所王亮研究员为论文的通讯作者。心理所陈栋副研究员,已毕业学生刘佳丽、谭政、肖雪和在读博士生吕鹏程,北京三博脑科医院王静主任和王梦阳主任,美国西北大学Ken Paller教授和德国波鸿鲁尔大学Nikolai Axmacher教授为该研究做出重要贡献。
论文信息:
Duan W#, Xu Z#, Chen D, Wang J, Liu J, Tan Z, Xiao X, Lv P, Wang M, Paller K A, Axmacher N, Wang L*. Electrophysiological signatures underlying variability in human memory consolidation. Nat Commun, 2025, 16(1): 2472. https://doi.org/10.1038/s41467-025-57766-x
附件下载:

