心理所研究揭示疼痛敏感性的脑脊网络预测模型
疼痛的高度主观性与个体差异既是基础研究的核心,也是临床精准镇痛与闭环神经调控(BCI)实现“解码—调控—反馈”的关键瓶颈。长期以来,现有研究多聚焦于“大脑中心”而忽视了脊髓作为关键关口的重要作用,且缺乏对运动皮层镇痛网络机制及脊髓耦合关系量化指标。因此,研究团队将研究视角拓展至“皮层-脑干-脊髓”全神经轴,旨在通过构建可泛化的疼痛敏感性解码模型,并结合运动皮层定向扰动,确立可操作、可推广的客观指标,从而实现从状态解码到因果调控的闭环验证。
中国科学院心理研究所孔亚卓研究组联合多家单位开展了一项研究,利用先进的皮层-脊髓同步功能磁共振成像(Corticospinal fMRI)技术,在6个健康人数据集和2个临床数据集上开发了一种全新的神经标志物——“皮层-脊髓疼痛敏感性标志物”(Corticospinal pain sensitivity signature, CSps)。该研究首次将大脑和脊髓作为一个整合的系统,揭示了皮层-脊髓功能连接模式在预测个体疼痛敏感性及临床疼痛中的重要作用。
该研究首先基于健康参与者的静息态皮层-脊髓功能连接数据,结合机器学习算法构建了CSps模型。研究发现,CSps能够准确预测个体的热痛阈值,并在多个独立的外部数据集中表现出优异的泛化能力(图1a-c)。此外,该模型具有良好的疼痛特异性,能够有效区分疼痛与非疼痛(如冷感觉)的神经反应(图1e),且不受个体焦虑、抑郁等心理因素及人口学变量的影响(图1d)。
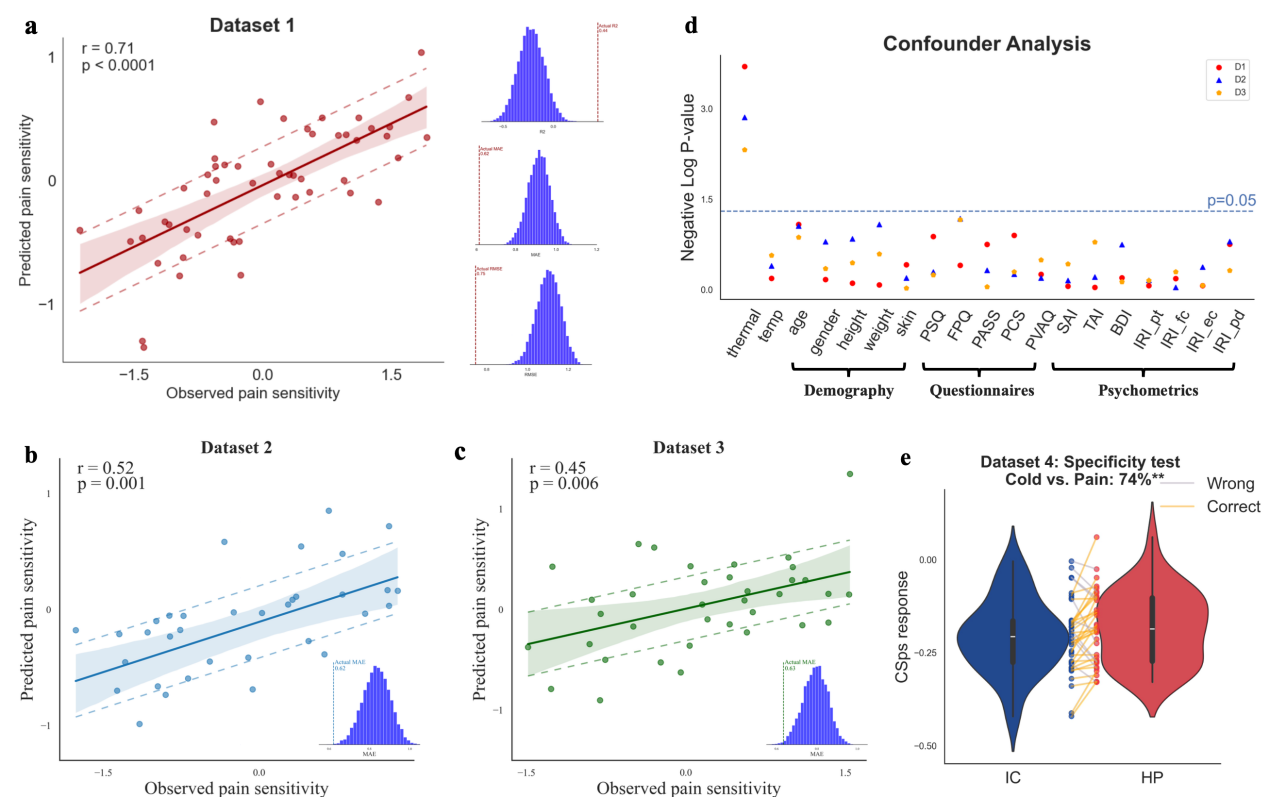
图1. CSps的预测效果
在临床应用验证中,研究者将CSps模型应用于两类不同病因的临床疼痛患者群体——亚急性期带状疱疹疼痛(ZAP)和糖尿病伴随慢性疼痛(DMC)。结果显示,基于健康人数据训练的CSps模型能够成功预测这两类患者的临床疼痛评分(图2a),且预测性能显著优于传统的仅基于脑部数据的模型或仅基于脊髓数据的模型(图2c)。这表明,整合了脑与脊髓信息的神经标志物能够捕捉到更核心的疼痛处理机制,架起了实验室疼痛测量与临床患者症状之间的桥梁。
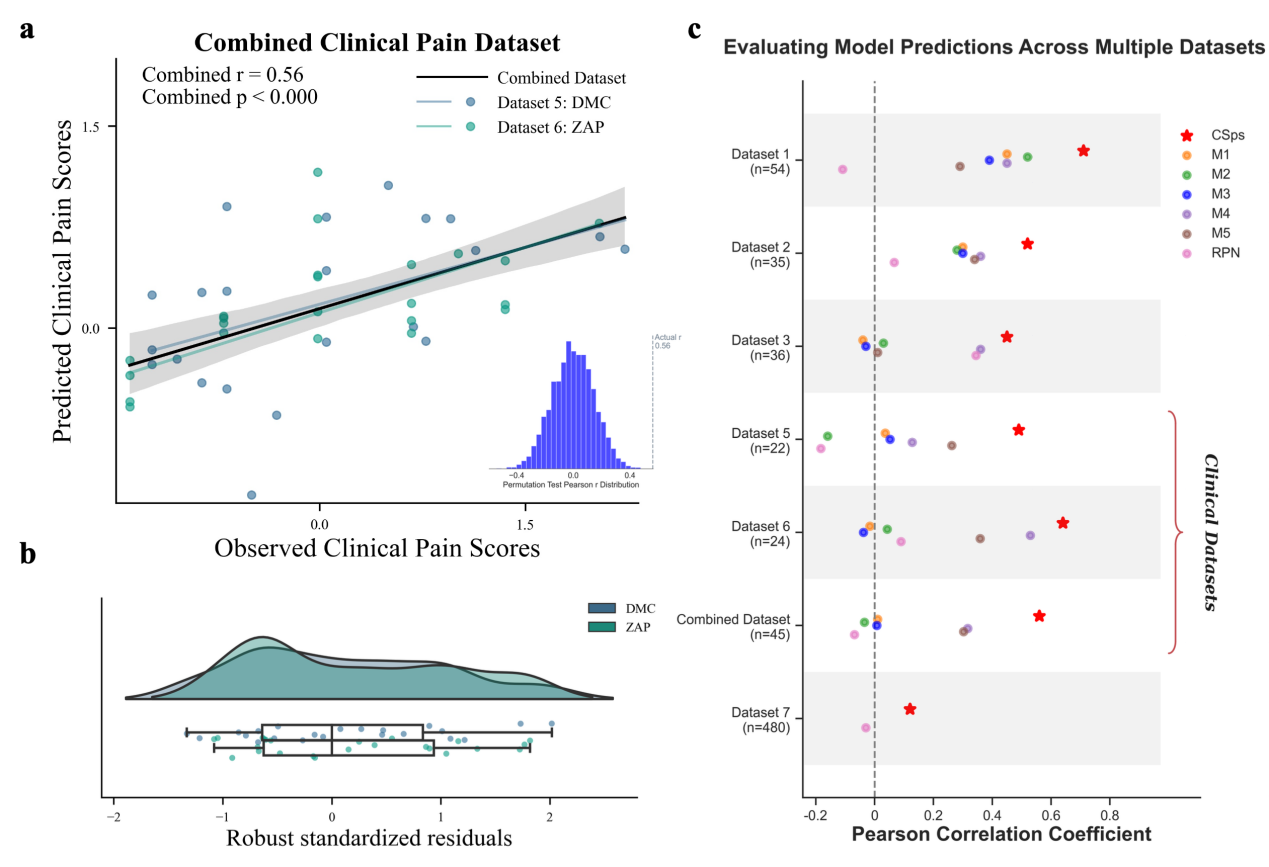
图2. CSps模型在慢性疼痛患者中的预测效果及与其他模型的比较
从模型结构看,CSps由一组稀疏连接构成,其中最突出的正向预测通路之一,是运动皮层与颈髓C4腹角之间的连接,形成一条“从皮层到脊髓的纵向整合轴”。基于这一模型指向性证据,研究团队进一步设计了关键的“调控-反馈”环节:在经伪刺激对照的10 Hz重复经颅磁刺激(rTMS)实验中,对M1进行定向扰动,并在刺激前后采集皮层-脊髓静息态成像及疼痛任务数据。结果显示,在真实M1刺激组中,CSps评分变化与疼痛感知变化显著相关(r=0.55),而伪刺激组不显著(图3d-e);同时,运动区-脊髓关键连接也出现与刺激相关的改变(图3c)。
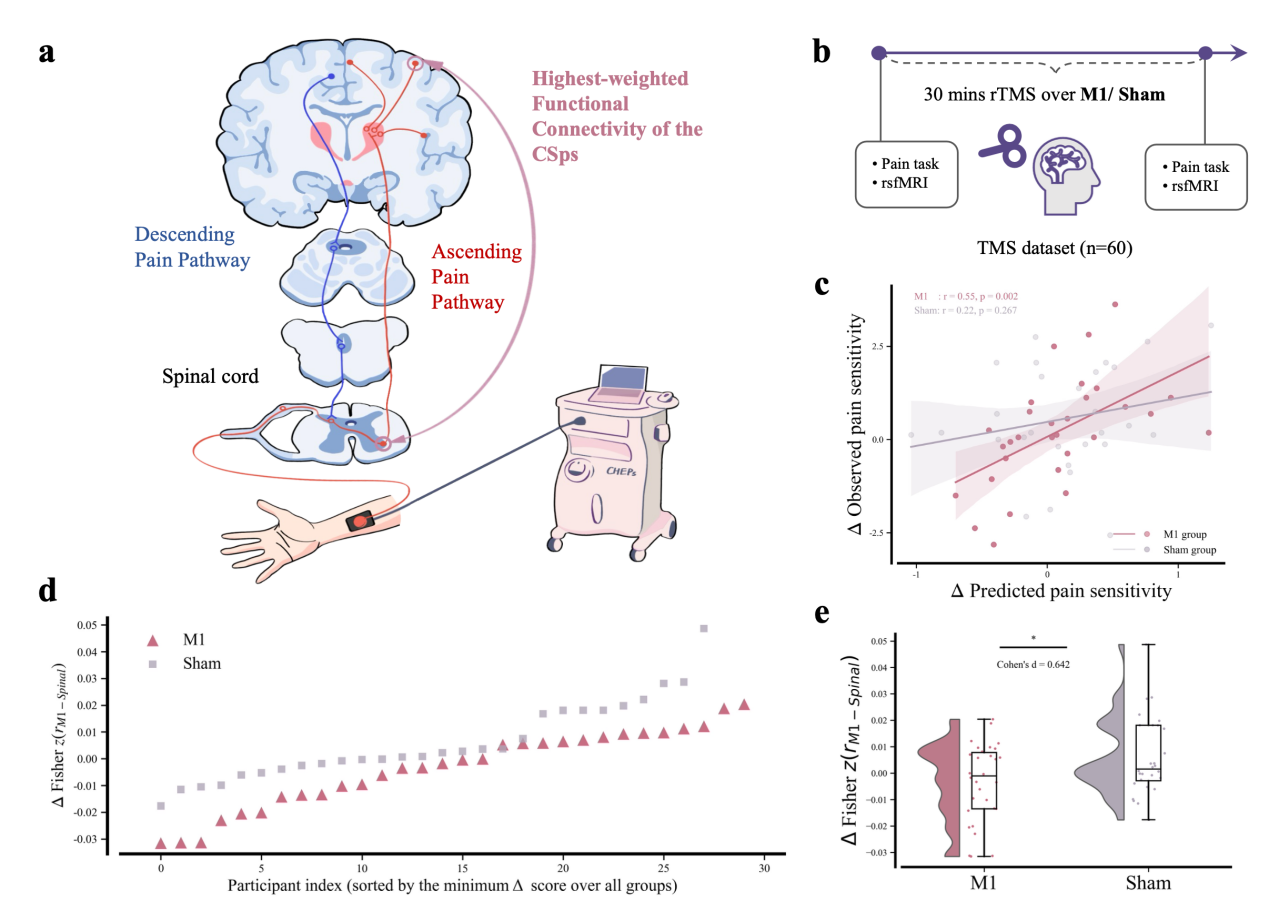
图3. rTMS干预揭示M1-脊髓连接与疼痛感知的因果联系
综上所述,该研究开发了一种基于皮层-脊髓功能连接的神经标志物CSps。CSps提供了一个以神经轴连接模式为基础、可量化的“疼痛相关表征”,有望与更高时间分辨率的脑电/肌电/植入式信号等结合,推动对疼痛意识状态的实时解码与分型。未来,通过实时监测CSps信号波动,结合闭环神经调控技术,有望实现对慢性疼痛患者的精准、即时干预,让“脑机接口止痛”成为可能。
该研究受到国家自然科学基金(82441056, 82071883, 82371937)、国家重点研发计划(2022YFC3500603)及北京市自然科学基金(IS23108)等项目的资助。
该研究成果已在线发表于Nature Communications。心理所博士生林校民为论文第一作者,心理所孔亚卓研究员、山东省立医院郭凌飞主任、首都医科大学宣武医院倪兵副主任、重庆大学附属肿瘤医院张久权主任、首都医科大学天坛医院刘亚欧主任为共同通讯作者。此外,心理所胡理研究员、利物浦大学Jonathan C. W. Brooks教授、达特茅斯学院Tor D. Wager教授以及牛津大学Irene Tracey教授等合作者,在研究设计、数据解释及论文修订方面也做出了重要贡献。
论文信息:Lin, X.-M., Guo, L.-F., Ni, B., et al. (2025). A corticospinal signature for interindividual pain sensitivity. Nature Communications. https://doi.org/10.1038/s41467-025-67132-6
附件下载:

